
翰宇药业全资子公司翰宇药业(武汉)顺利完成了为期5天的美国FDA现场核查,FDA按照cGMP标准(现行药品生产质量管理规范)对翰宇药业原料药生产系统、设备设施系统、物料系统、质量控制系统、包装贴签系统以及质量系统的现场及各类体系文件进行了严苛、全面、细致的查验,并于11月29日下午,给予了“零缺陷”结论,即未收到任何483表(不符合项)!
此次顺利通过FDA检查,标志着翰宇药业继2023年龙华总部研发中心“零缺陷”通过FDA检查之后,再次取得这一重要成果。这不仅再次验证了翰宇药业在质量管理方面的国际领先水平,也标志着公司在国际化进程中的步伐更加稳健,迈向更高的发展目标。
FDA(美国食品药品监督管理局)是由美国联邦政府授权,负责监管食品、药品、化妆品和医疗器械等产品质量与安全的国家机构。通过FDA的检查,意味着产品符合全球高标准,被公认为有效且安全,具有全球市场的认可度。
翰宇药业始终秉持质量至上的发展理念,旗下坪山制剂生产基地、武汉原料药生产基地、龙华总部研发中心等均已通过FDA cGMP标准现场检查,且多次通过欧盟、韩国、巴西等国家和地区的GMP认证。这为公司利拉鲁肽上市销售以及未来其他产品的国际化奠定了坚实基础。
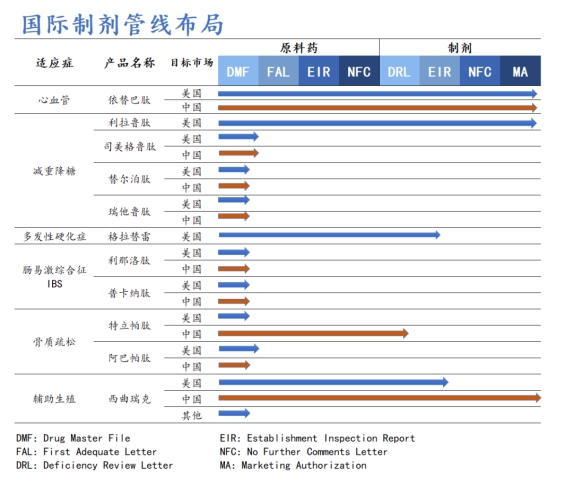
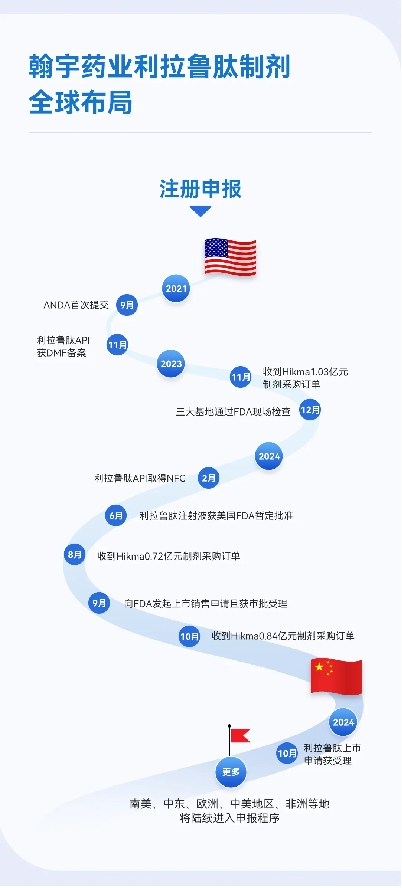
国际制剂管线方面,作为多肽行业的先进企业,翰宇药业坚持技术创新,不断拓展产品管线布局,积极寻找优势互补、资源共享的优质国际合作伙伴,国际管线布局涵盖利拉鲁肽、司美格鲁肽、替尔泊肽、瑞他鲁肽、格拉替雷等重磅产品。其中利拉鲁肽已于9月23日向FDA发起上市销售申请且获美国FDA受理,目标审评日期为2024年12月23日。
此外,多肽原料药方面,翰宇药业能够实现几乎所有已上市多肽药物原料药的开发和生产,并对长链多肽原料药(氨基酸数量在30个以上)的开发具有独到的技术优势。目前,公司已有30多个多肽原料药取得《药品生产许可证》,为满足海外市场增量需求,翰宇药业武汉原料药生产基地产能可达吨级。 未来,翰宇药业将继续发挥FDA认证带来的质量优势,不断增强综合竞争力,为公司的高质量发展和提升国际市场品牌影响力打下更加坚实的基础!